

我們相識
鏈冶材已陪伴您個月時間了
這一年,您共登錄鏈冶材超過天
發布了條資訊
結識了位合作伙伴
更多...


我們相識
鏈冶材已陪伴您個月時間了
這一年,您共登錄鏈冶材超過天
發布了條資訊
結識了位合作伙伴
更多...

中包覆蓋劑對不銹鋼夾雜成分變化的影響
在1773K溫度下,調研了中間覆蓋劑對Si鎮靜鋼的304 (18%Cr-8%Ni)不銹鋼中非金屬夾雜物演變的影響。鋼水與CaO-Al2O3-MgO覆蓋劑的界面反應導致鋁從液渣中析出到鋼液中,從而造成中間包鋼水中的氧含量下降。覆蓋劑中的鋁將鋼中原有的Mn-硅酸鹽夾雜物改性為富鋁夾雜物。由于鋼與CaO-Al2O3-MgO覆蓋劑反應時,鋼中的氧含量降低,形成氧化鋁的過飽和程度過低,無法在鋼中析出新的氧化鋁顆粒。通過分析夾雜物的密度函數(PDF)結果,可以發現尖晶石型夾雜物的生長是由鋁和鎂在鋼中的擴散引起的。另一方面,加入CaO-SiO2-MgO覆蓋劑后,鋼的成分和夾雜物的演變變化很小。此外,基于耐材-渣-金屬-夾雜物(ReSMI)多相反應模型,對連鑄中間包過程中鋼液中夾雜物的演化進行了計算模擬。
關鍵詞:中間包覆蓋劑;非金屬夾雜物;304不銹鋼;過飽和度;密度函數(PDF);尖晶石;耐材-渣-金屬-夾雜物(ReSMI)多相反應模型。
1. 介紹
已經認識到細小的非金屬夾雜物(NMI)的形成在鐵素體不銹鋼的連鑄過程中有利于形成等軸晶,充當了δ鐵素體的異質形核點。[1-4]另一方面,眾所周知,非金屬夾雜物具有高熔點和高的強度,如氧化鋁和MgAl2O4尖晶石,造成浸入式水口的堵塞,形成不銹鋼表面缺陷。許多學者調查了不銹鋼在不同煉鋼過程中NMI的演變。[5 – 17]
由于中間包是連鑄鋼水前去除NMI的*后一個冶金反應器,因此有必要研究中間包中夾雜物的形成機理,以提高鑄坯產品的清潔度。由于中間包覆蓋劑在穩定澆注階段覆蓋鋼水后,鋼液在中間包中不會暴露在空氣中,許多研究者關注覆蓋劑與鋼水之間的界面反應造成的鋼水二次氧化。[18-20]據報道,Si鎮靜鋼和CaO-Al2O3-MgO覆蓋劑之間的熱力學平衡提高了非金屬夾雜物中的氧化鋁含量。[21,22]但是,硅鎮靜的304 (18%Cr-8%Ni)不銹鋼中間包覆蓋劑/鋼水之間的反應生成氧化鋁和尖晶石夾雜的機理尚不完全清楚。
研究了鋼中夾雜物粒子尺寸分布,以了解脫氧后非金屬夾雜物的形核、長大和去除機制。[23~28] Zhang和Lee[23]表明,氧擴散和Ostwald熟化本質上決定了脫氧初期氧化鋁粒子的生長,而隨著成核后時間的延長,由布朗凝聚、湍流凝聚、Stokes凝聚和梯度凝聚引起的碰撞機制顯著影響了粒子的生長。由于密度函數(PDF)排除了原始使用者的隨意性,因此,在實驗室實驗和工廠煉鋼過程中,夾雜物的PDF被用于進一步理解脫氧或二次氧化后鋼液中NMI的生長機制。[24~28]
為了理解金屬和覆蓋劑之間的化學反應,人們廣泛建立了各種動力學模型,包括初煉爐、二次精煉、連鑄中間包和結晶器,特別是耐材-覆蓋劑-金屬-夾雜物(ReSMI)多相反應模型。該模型由有效平衡反應區(EERZ)模型[31,37,41]發展而來,適用于各種冶金過程,不僅可以預測金屬和鋼的成分變化,還可以預測鋼中夾雜物隨反應時間的演變,這個模型是有用的,因為它應用了金屬相和渣相的有效反應體積,以及MgO從耐火材料到渣相的溶解。[39,40,43]近來,采用耐材-覆蓋劑-金屬-夾雜物ReSMI多相反應模型研究了連鑄過程中鋼水的二次氧化行為和中間包中NMI的演化。
在本研究中,結合基于耐材-覆蓋劑-金屬-夾雜物ReSMI多相反應模型的工業規模中間包過程的計算模擬,研究了具有鈣硅酸鹽和鈣鋁酸鹽系中間包覆蓋劑的304不銹鋼中非金屬夾雜物NMI的形成機理。
2. 實驗程序
2.1. 實驗過程
目前的實驗中使用SiO2和Al2O3試劑,在1 273 K下,用CaCO3和MgCO3試劑煅燒10 小時,得到CaO和MgO。稱量粉末并混合,得到表1所示的合成渣。混合物在1873 K的石墨坩堝中熔化1小時,然后在用水冷卻的銅板上淬火。將磨碎的合成渣在箱式爐中加熱*1273 K,以除去渣中的溶解碳。
表1 本研究中使用的中間包覆蓋劑的初始成分(wt%)
本實驗裝置的原理圖如圖1所示,在鎂質坩堝(99.9%,外徑x內徑x高度=60 mm×50 mm ×120 mm中含有600 克 304不銹鋼(18%Cr-8%Ni-1%Mn-0.4%Si),坩堝設置在石英反應室內的高頻感應爐,用機械旋轉泵將反應室抽真空后,向反應室注入Ar-3%H2氣體混合物。然后,用B型熱電偶和比例積分微分控制器將氧化鎂坩堝中的不銹鋼加熱到1773K。
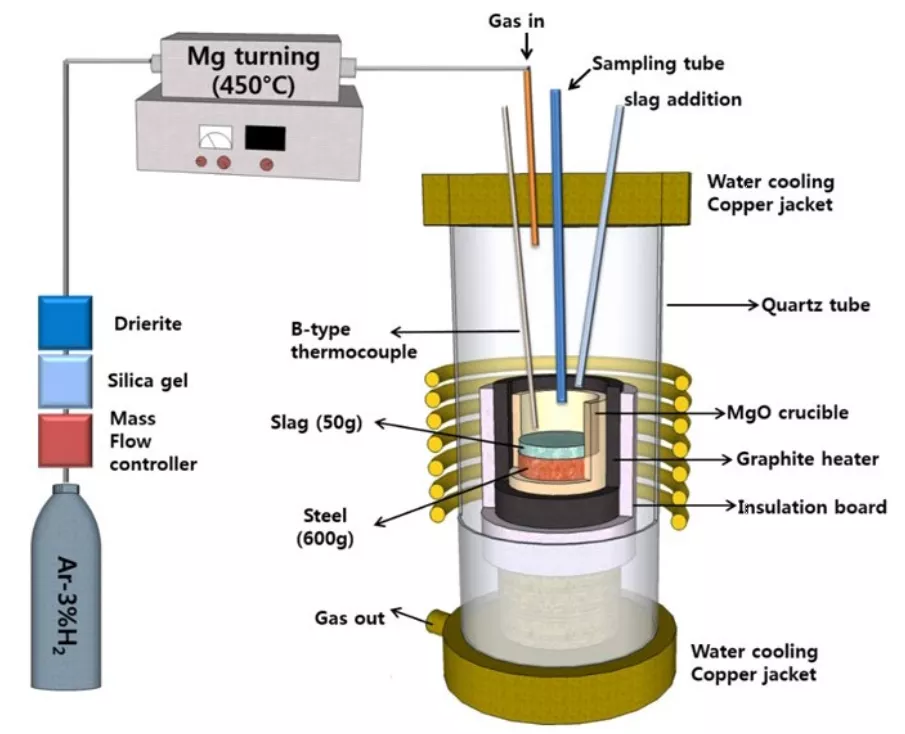
圖1 實驗裝置示意圖
添加合成渣之前在1 773 K溫度下進行取樣,使用石英取樣器(外徑OD 6mm,內徑ID 4mm)。一旦金屬取樣通過石英管(外徑14mm×內徑12×高度500mm)取樣后,馬上添加 50 g合成渣在鋼液上。加入合成渣后,用石英取樣器分別在5、10、15和30分鐘時間后獲得金屬試樣,使用氣體燃燒分析儀(TC-300, LECO Co.)測定鋼試樣中的總氧含量。使用電感耦合等離子體原子發射光譜(ICP-AES, ACROS II, Spectrs)分析了鋼樣品中的Si、Al、Mn、Ni和Cr的含量。
2.2. 自動特征分析(AFA)系統和電解萃取(EE)方法表征夾雜物
自動特征分析(AFA)技術已廣泛應用于定量表征拋光鋼試樣中的夾雜物。對直徑為φ4 mm的鋼試樣的截面進行拋光處理。利用場發射掃描電子顯微鏡(FE-SEM, JSM-6980LV, JEOL)和配備INCA Feature (Oxford Instruments)的能譜儀(EDS)對鋼中夾雜物的組成和大小進行了測定。加速電壓為20 kV,放大倍數為×500,像元尺寸為0.5 μm,檢測到的夾雜物極限直徑為1 μm。
用10%的AA(10%乙酰丙酮- 1%四甲基氯化銨-甲醇)溶液電解萃取法將夾雜物從鋼基體中分離出來,[45~47] 500 mA電流作用3小時,含夾雜物的溶液通過孔徑為0.1 um的聚碳酸酯膜濾膜過濾器過濾。然后,在室溫下,在15 kV的工作電壓下,使用FE-SEM(MIRA 3, TESCAN)和EDS觀察到濾膜上的夾雜物。
2.3. 夾雜物總群密度函數(PDF)
從自動特征分析AFA技術獲得的夾雜物數據在體視學分析中是有限的,因為數據是從二維(2D)剖面獲得的。許多研究人員采用了總群密度函數(PDF)來研究鋼試樣中夾雜物的尺寸分布,因為PDF消除了用戶造成的任何隨意性。[23~28]長度為?4的PDF的單位定義如下:
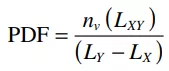 (1)
(1)
式中,nv(LXY)為每個給定大小的試樣體積中夾雜物出現的頻率,(LY?LX)為高倍試樣寬度。CSD修整程序版本1.5,將2D數據轉化為3D數據,將AFA納入數據轉化為PDF大小分布。每個夾雜物的面積、長度和寬度的原始數據輸入到程序里,根據夾雜物顆粒的短尺寸、中間尺寸、長尺寸和圓度來估計整體形狀。該程序根據輸入數據計算PDF大小分布。
3. 結果與討論
3.1. 304不銹鋼鋼水成分變化
如圖2所示,不銹鋼鋼水成分隨CaO-SiO2-MgO和CaO-Al2O3-MgO覆蓋劑反應時間的變化,鋼中鉻、鎳、錳、硅的含量隨反應時間的變化可忽略不計。另外,在鋼水中加入CaO-Al2O3-MgO覆蓋劑后,鋼中的鋁含量不斷增加,達到150 ppm左右。鋁的析出是由于鋼水中溶解的硅在1773 K時使CaO-Al2O3-MgO渣中的Al2O3鋼水發生化學反應而發生的:
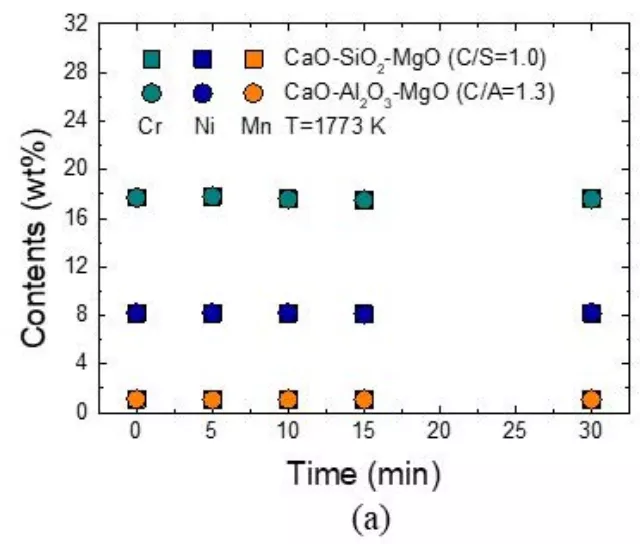
圖2 (a) [Cr], [Ni], [Mn]的成分變化;(b) (Si)和(C)和 CaO-SiO2-MgO和CaO-Al2O3-MgO覆蓋劑在鋼中的[Al]隨反應時間的變化規律
 (2)
(2)
Roy團隊[34]提出了實驗和模擬結果,在鋁脫氧鋼((Al) =0.03 ~ 0.05 wt %)覆蓋劑吸收鋼中的Al,基于鋼中的硅(0.8 - 1.9 wt %)和渣中(CaO-Al2O3-MgO)的氧化鋁(渣中的C / A = 1.0 - 1.4,SiO2= 5.3 ~ 10.1 wt %,MgO= 6.8 ~ 11.1 wt %)化學反應,導致覆蓋劑中SiO2含量增加。硅鎮靜不銹鋼熔鋼水中的鋁含量在幾個ppm以下,本研究中,由于在加入覆蓋劑,鋁可以通過與CaO-Al2O3-MgO覆蓋劑的化學反應轉移出來進入鋼中。
鋼液中總氧含量如圖3所示,在加入CaO-SiO2-MgO和CaO-Al2O3-MgO覆蓋劑之前,Si鎮靜不銹鋼的初始氧含量為50 ppm左右。加入CaO-SiO2-MgO覆蓋劑后,鋼中氧的初始含量基本保持不變。另一方面,加入CaO-Al2O3-MgO覆蓋劑后,鋼中的氧含量在10分鐘時持續下降到20ppm左右,直到30分鐘時基本保持不變。
圖3 CaO-SiO2-MgO覆蓋劑和CaO-Al2O3-MgO覆蓋劑對鋼中T.[O]的組成隨反應時間的變化
利用FactSageTM7.3結合FToxid和FTmisc數據庫計算得到的穩定性圖,如圖4所示。穩定圖的實線表示鋼水中計算出的可溶性氧。由于CaO-SiO2-MgO覆蓋劑的添加對鋼的成分影響較小,因此圖4中沒有顯示CaO-SiO2-MgO覆蓋劑添加的數據。假設加入CaO-Al2O3-MgO覆蓋劑前鋼中鋁的含量在1 - 2ppm左右,則計算出鋼中的可溶性氧為80 -100ppm,隨著反應時間的延長,鋼中鋁的含量不斷增加,可溶性氧的含量不斷降低到幾個ppm。
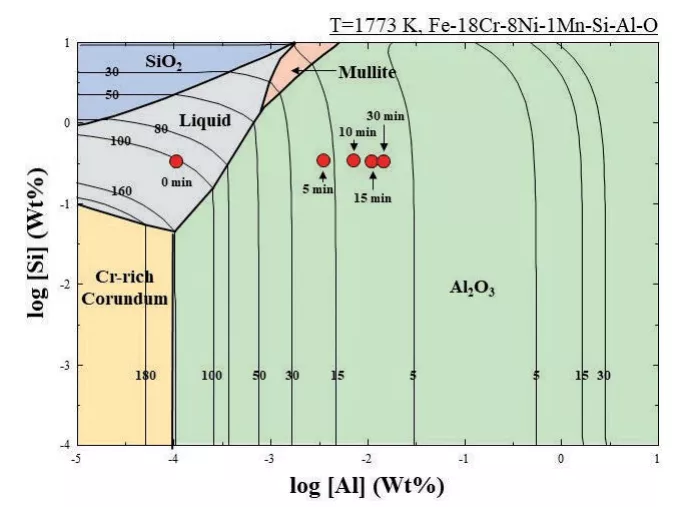
圖4 1773 K時Fe-18%Cr-8%Ni-1%Mn-Si-Al-O鋼中的穩定性優勢圖(由FactSageTM7.3計算)
Tanaka團隊[48,49]研究了鋁鎮靜鋼與CaO-SiO2-Al2O3(-CaF2)渣之間動態界面反應的機理:1)界面處的硅分解和氧吸附;2)界面處的硅擴散到中間包鋼水中,氧殘留在界面層中;3)界面處的氧解吸到鋼水中,氧與界面處的鋁反應形成氧化鋁;4)氧化硅從覆蓋劑進入到界面,與氧和鋁進行反應;5)由于在界面上形成的氧化鋁積累,氧化硅大塊堵塞物形成,由于氧的解析和氧和鋁的反應,界面上的自由氧減少。
本研究中的動態界面現象與Tanaka等人的結果相反,CaO-Al2O3-MgO覆蓋劑添加到硅鎮靜不銹鋼鋼水中,鋁會累積在鋼的亞界面層,這是因為鋼中的硅造成渣中的亞界面中的氧化鋁降低,如公式(2)所示。在界面層釋放的鋁與氧反應,導致降低了界面層的氧含量。鋁的解析從界面向鋼水與氧從鋼水向界面的轉移同時發生。因此,加入CaO-Al2O3-MgO覆蓋劑后,鋼中氧含量隨反應時間的增加而降低。根據Tanaka等人的概念,渣-金屬界面動態行為的相關機理如圖5所示。[48,49]
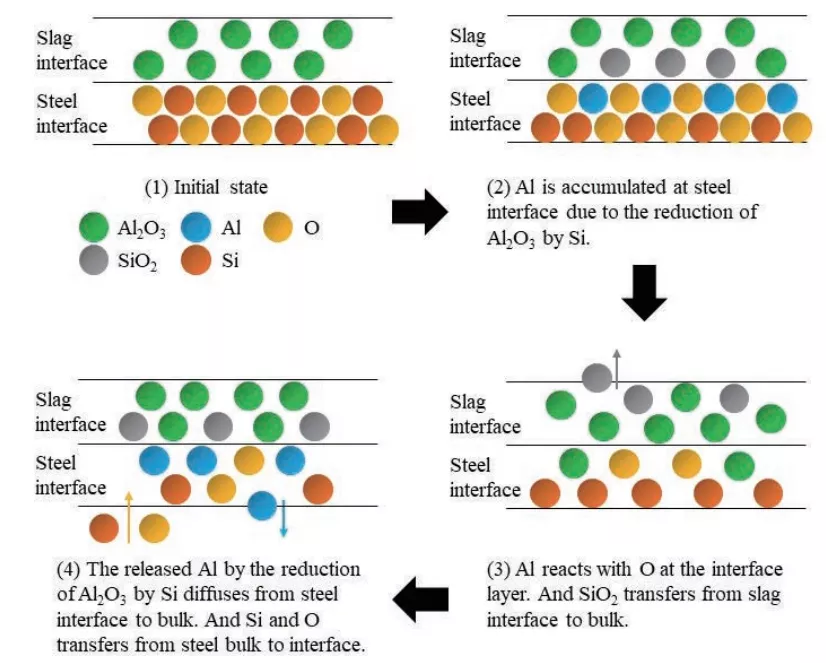
圖5 化學反應作用下渣-金屬界面動力學行為的微觀機理((1)開始階段,彩色圓對應不同元素和物質;(2)由于Si的作用,AI2O3還原,Al在鋼水界面上積累;(3)AL和O在界面層上反應,SiO2從渣界面進入渣中;(4)從鋼中Si擴散進入渣中還原AL2O3而釋放O)
值得注意的是,隨著反應時間的延長,鋁含量不斷增加,而在10分鐘后,氧含量幾乎不變。由于在渣中增加了鋁含量,鋼水中形成氧化鋁夾雜的驅動力加大(見圖4),氧在10min后的行為與非金屬夾雜物的形成密切相關。
3.2. 渣-鋼反應中的非金屬夾雜物的演化
與CaO-Al2O3-MgO覆蓋劑反應的非金屬夾雜物成分隨反應時間的變化如圖6所示,由于與CaO-SiO2-MgO覆蓋劑反應的夾雜物成分與初始成分相比變化不大,因此圖6中沒有說明CaO-SiO2-MgO覆蓋劑的情況。在加入CaO-Al2O3-MgO覆蓋劑前,MnO-SiO2-Al2O3三元相圖中,夾雜物成分主要位于液相和富SiO2的Mn -硅酸鹽區。隨著反應時間的延長,隨著鋁含量的增加,氧化鋁夾雜物在鋼中自發析出(圖4),10 分鐘時,夾雜物成分從相圖上的MnO-SiO2二元區向富氧化鋁區移動。10 分鐘后,隨著反應時間的延長,夾雜物中MgO的含量不斷增加,因此,鋼中以尖晶石夾雜物為主。在鋁鎮靜鋼中,尖晶石夾雜物的形成已被證實。氧化鋁夾雜物與渣相鎂的反應如下:[10,20,44]
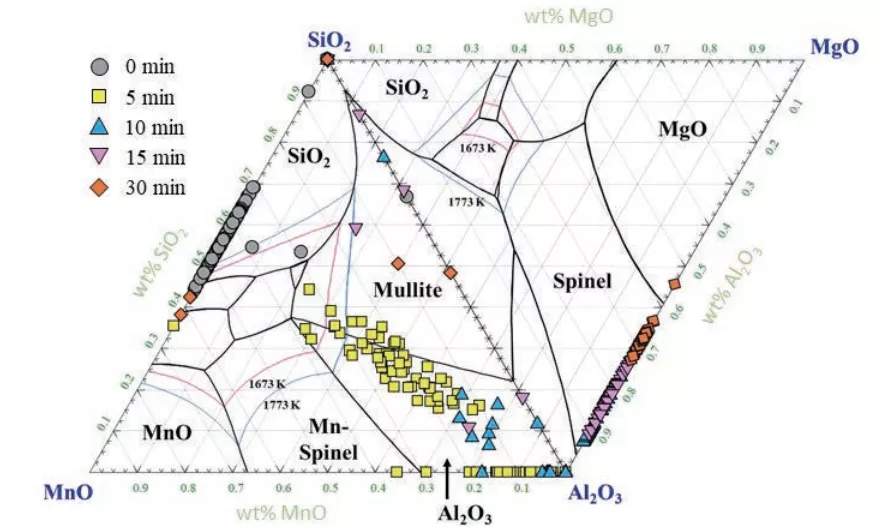
圖6 隨著反應時間的延長,CaO-Al2O3-MgO覆蓋劑與鋼中非金屬夾雜物的成分發生變化
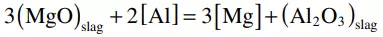 (3)
(3)
 (4)
(4)
在1773 K時,Fe-18%Cr-8%Ni-1%Mn-Si-Al-O體系的穩定性圖如圖7所示,與圖4相比,10、15和30 分鐘處的尖晶石相區域氧溶解度值較低,說明即使是1ppm的渣相鎂夾雜也能促進鋼液中尖晶石夾雜的形成。
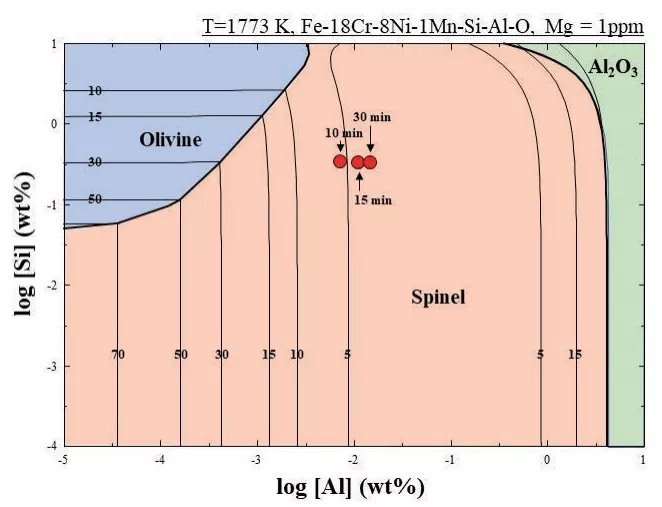
圖7 1773 K時Fe-18%Cr-8%Ni-1%Mn-Si-Al-O (1 ppm Mg)體系的穩定性優勢圖(由FactSageTM7.3計算)
圖8顯示了與CaO-SiO2-MgO (C/S = 1.0)和CaO-Al2O3-MgO (C/A = 1.3)覆蓋劑反應的鋼中夾雜物的平均尺寸隨反應時間的變化規律。添加CaO-SiO2-MgO覆蓋劑后,MnO-SiO2夾雜物的平均尺寸(1.5 μm以下)隨反應時間的變化很小,這是因為該覆蓋劑對MnO-SiO2夾雜物生長的驅動力很小。當CaO-Al2O3-MgO覆蓋劑加入鋼中,隨著反應時間的延長,夾雜物的平均尺寸從1.5 μm增大到3 μm左右。
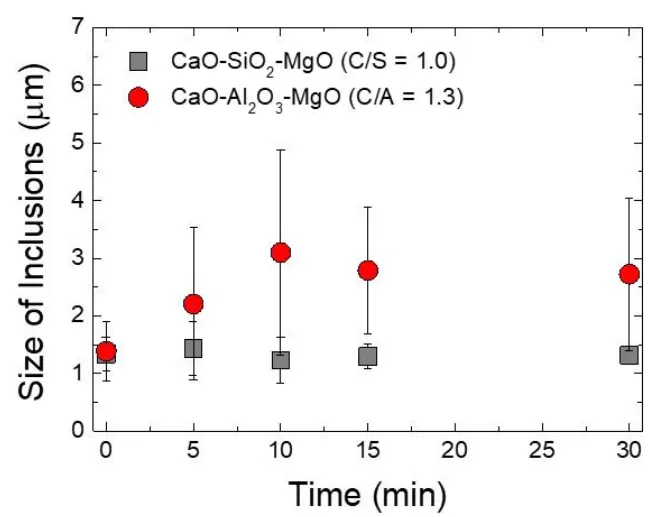
圖8 隨著反應時間的延長,鋼中非金屬夾雜物的平均尺寸與CaO-SiO2-MgO和CaO-Al2O3-MgO覆蓋劑發生反應
在圖9中,計算出的夾雜物密度函數PDF在不同覆蓋劑組成和反應時間以對數關系繪制在每個夾雜物尺寸上,與反應時間無關,使用CaO-SiO2-MgO覆蓋劑的夾雜物密度函數PDF呈線性下降趨勢,呈現分形分布(盡管存在一定的散射)。使用 CaO-Al2O3-MgO覆蓋劑的密度函數PDF在0和10分鐘與使用CaO-SiO2-MgO覆蓋劑夾雜物的PDF也有類似的趨勢,但隨后反應時間超過10分鐘夾雜物的PDF顯示了對數正態分布。煉鋼過程中鋁脫氧鋼脫氧或二次氧化,因為溶質的擴散和夾雜物的粗化,夾雜物的長大具有對數正態形狀。[25~27]夾雜物的密度函數分形分布表明,夾雜物的生長是由穩態解體以及溶質和夾雜物的聚合處于平衡后而確定,10分鐘后PDF的對數正態分布表明,鋁和鎂的析出對鋼中夾雜物的生長有影響。
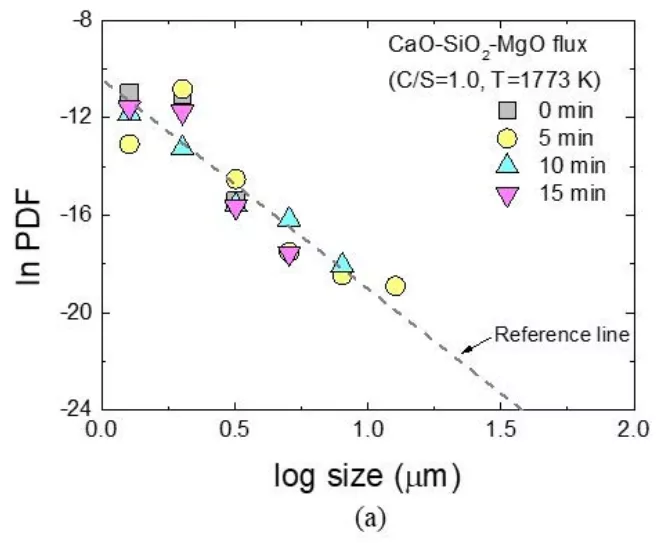
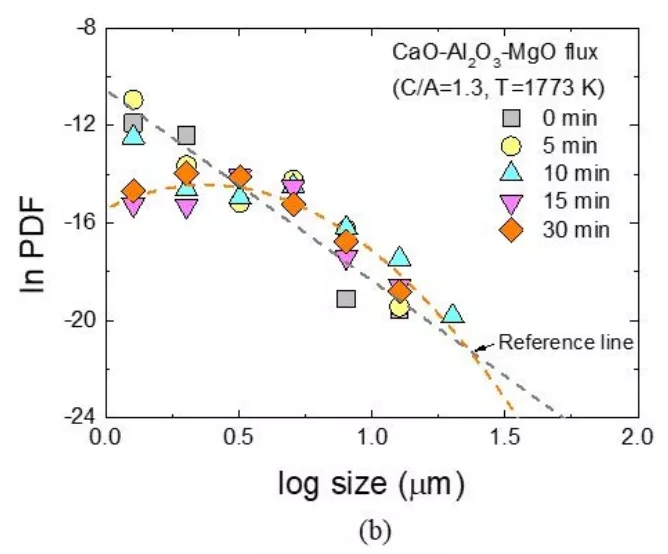
圖9 隨著反應時間的延長,鋼中非金屬夾雜物的密度函數(PDF)與(a) CaO-SiO2-MgO和(b) CaO-Al2O3-MgO覆蓋劑發生反應
試樣電解萃取后,在不同反應時間下,CaO-SiO2-MgO和CaO-Al2O3-MgO覆蓋劑與夾雜物反應后的形貌如圖10所示。EDS數據中C和Pt的峰值來源于聚碳酸酯膜和Pt涂層。在覆蓋劑加入鋼中之前,觀察到球狀的MnO-SiO2夾雜。當CaO-SiO2-MgO覆蓋劑加入到鋼液中,MnO-SiO2夾雜物的組成和形態均不隨反應時間發生明顯變化。MnO-SiO2主要位于液態(或SiO2飽和)區域(圖4和圖6),因此MnO-SiO2夾雜物在鋼水中保持球形形態,降低了其表面能。當CaO-Al2O3-MgO覆蓋劑加入到鋼水中,在5分鐘后觀察到球狀的MnO -SiO2 - Al2O3夾雜物,這是由于鋁通過公式(2)從渣中轉移出來,導致MnO -SiO2夾雜物中MnO和SiO2的還原,如公式(5)和公式(6)所示。
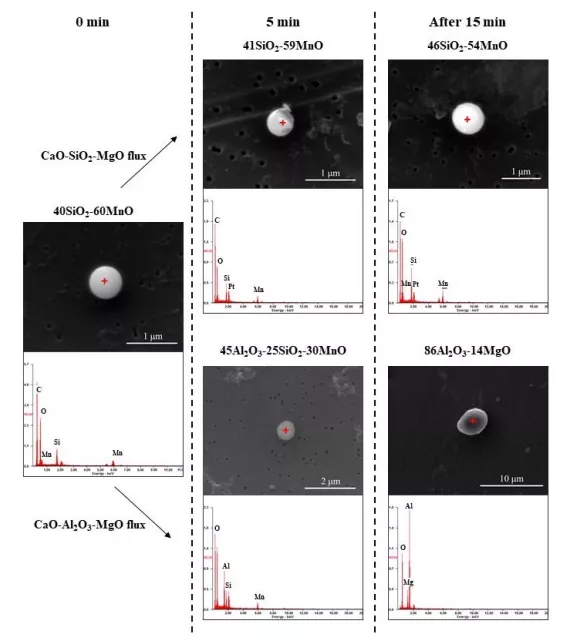
圖10 電解萃取后,觀察了鋼中非金屬夾雜物與CaO-SiO2-MgO和CaO-Al2O3-MgO覆蓋劑的反應形態
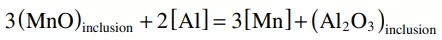 (5)
(5)
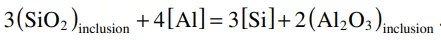 (6)
(6)
*后,在15分鐘后觀察到多面體尖晶石夾雜,見公式(3)和(4)。,
氧化鋁夾雜物的形成強烈依賴于氧化鋁的過飽和程度,即SAl2O3,其定義如下:[50]
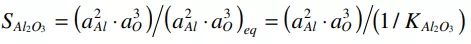 (7)
(7)
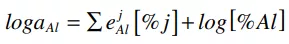 (8)
(8)
 (9)
(9)
式中,aAl,aO,eij為鋁的活度、氧的活度和相互作用系數(i = Al和O;j = Al, O, Si, Mn, Ni和Cr),分別為1 wt%的標準狀態。計算所用的相互作用系數如表2所示,[51~53] 計算過飽和度如圖11所示。隨著鋁含量隨反應時間的增加,鋼中計算出的SAl23O在10分鐘后略有增加。Suito和Ohta[54]報道了氧化鋁沉淀的每摩爾氧的過飽和度(SO)的臨界值試樣結果約為15,理論計算的結果為529。在本研究中,由于覆蓋劑和金屬之間的界面反應消耗了可溶性氧,計算出的SAl23O太低,無法在鋼中形成新的氧化鋁粒子,即使鋁含量隨著反應時間的增加而增加。
表2 在本研究中交互系數eij [51~53]
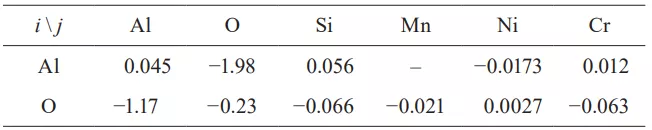
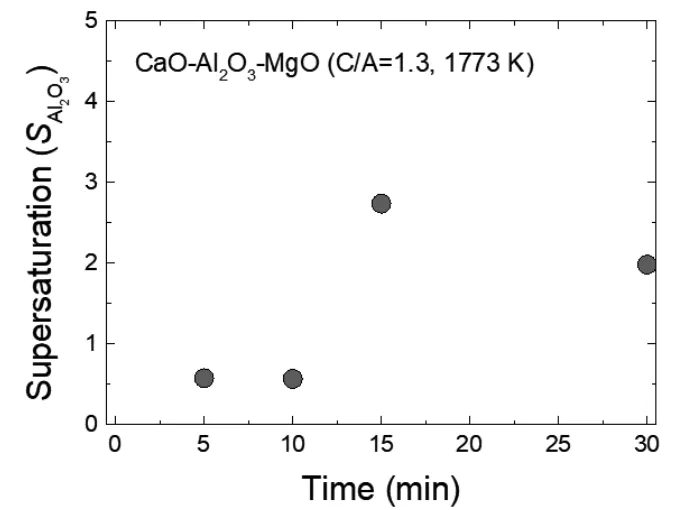
圖11 隨著反應時間的延長,鋼中析出的氧化鋁夾雜物與CaO-Al2O3-MgO覆蓋劑發生過飽和反應
Dekkers等人[55]證明了非金屬夾雜物的形貌是由相對生長速率、表面相對能或表面雜質的存在決定的。過度飽和的程度是一個重要因素來理解夾雜物的形貌,因為過度飽和的程度正比于增長速率。[55,56]過飽和度的增加引起的夾雜物形貌的變化,從多面體結構由不同的機理變化為樹枝狀形態和球狀。[55,56] 因此,由于鋼在15分鐘后過飽和度較低,所以觀察到夾雜物的多面體形態(圖10)。
如圖12所示,將CaO-Al2O3-MgO覆蓋劑添加到Si -鎮靜不銹鋼鋼水中,尖晶石夾雜物形成機理示意圖。因為鋁從渣中轉移出來,降低了已有的MnO - SiO2夾雜物中的MnO和SiO2,如公式(5)公式(6)所示,形成富鋁夾雜物。隨著鋼中鋁含量的增加,鎂也從渣中轉移出來。鎂通過公式(4)將富鋁夾雜物轉化為尖晶石型夾雜物。*后,鋁、鎂、氧的擴散使尖晶石型夾雜物生長,形成多面體形態。
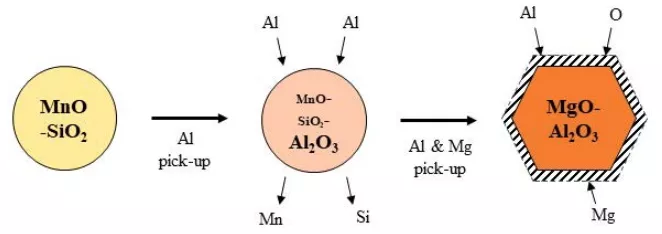
圖12 鋼中非金屬夾雜物與CaO-Al2O3-MgO覆蓋劑反應的演化機理示意圖
綜上所述,CaO-Al2O3基覆蓋劑使鋁和鎂的析出進入鋼中,使初始的MnO-SiO2型夾雜物轉變為鋁型和尖晶石型夾雜物,而CaO-SiO2基覆蓋劑劑維持了初始的硅酸鹽夾雜物。因此,在生產高潔凈度Si鎮靜不銹鋼時,建議使用CaO-SiO2基覆蓋劑,以抑制中間包有害夾雜物的形成。
3.3. 連鑄中間包304不銹鋼鋼水中夾雜物的演化預測
從鋼包鋼水倒入中間包,鋼水結晶器中結晶凝固前,在中間包流場中流動了幾分鐘時間,鋼水與中間包覆蓋劑反應,導致二次氧化的氧化鋁夾雜的形成。[20,44]在目前的研究中,用來預測計算模擬夾雜物在中間包鋼水中的演變是基于耐材-渣-金屬-夾雜物ReSMI多相反應模型進行的,ReSMI多相反應模型已成功應用于FactSageTM (版本37~ 44)的動力學計算(版本為7.3),利用FTmisc和FToxid數據庫進行宏觀仿真。
為了簡化模型和計算,模擬采用以下假設:1)鋼液與渣在中間包穩態反應,沒有外部干預,2)鋼水和渣的尺寸在計算單位時間內是不變的,3)單位時間內鋼液移動到下一步時,反應后單位時間內渣仍保留,4)中間包模擬時鋼與鋼、渣與渣的混合可以忽略不計(圖13)。
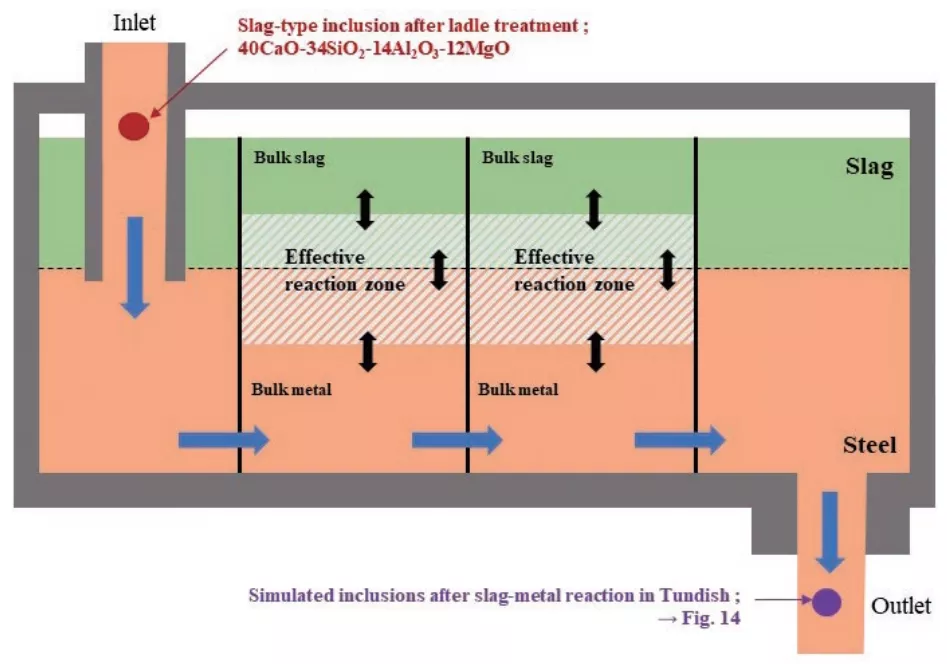
圖13 連鑄過程中中間包內反應的示意圖(在中間包內模擬渣-鋼反應后的夾雜物:→圖14)
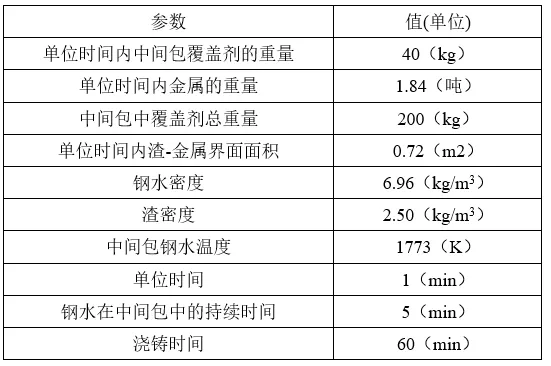
據報道,在CSAM體系中,在鋼包精煉階段后,在鋼水中通常含有平均含量為40 wt% CaO、34 wt% SiO2、14 wt% Al2O3和12 wt% MgO的外生渣類夾雜物。[9,17]假設中間包的初始鋼水中含有50ppm的CSAM夾雜物,對單位時間內的每次鋼液在中間包內的整個時間進行模擬,輸出模擬結果,這些數據與中間包出口的鋼數據相對應。本模擬的詳細條件如表3所示。
表3 預測連鑄中間包中夾雜物演化的模擬條件
使用不同的覆蓋劑,預報中間包中304不銹鋼液中夾雜物演化的澆鑄時間函數計算結果如圖14所示,尖晶石和黃長石基的夾雜物在鋼水中形成,在開始澆鑄時期,由于中間包鋼-渣界面的反應,參考原始渣類CSAM分析夾雜體系中的氧化鋁,在全部夾雜物中氧化鋁含量也會從14 wt %開始增加到43%。隨著澆鑄時間的延長,尖晶石、黃長石和氧化鋁夾雜物的含量比例不斷降低。這是因為CaO-Al2O3-MgO覆蓋劑在不增加輸入的情況下,隨著渣/金屬反應的進行,覆蓋劑中的Al2O3含量不斷降低,并且隨著澆鑄的進行,與覆蓋劑反應的鋼水在中間包中不斷更新。另一方面,使用CaO-SiO2-MgO覆蓋劑在中間包中模擬鑄造過程中,304不銹鋼液中夾雜物保持其初始成分(圖14(b)實線)。
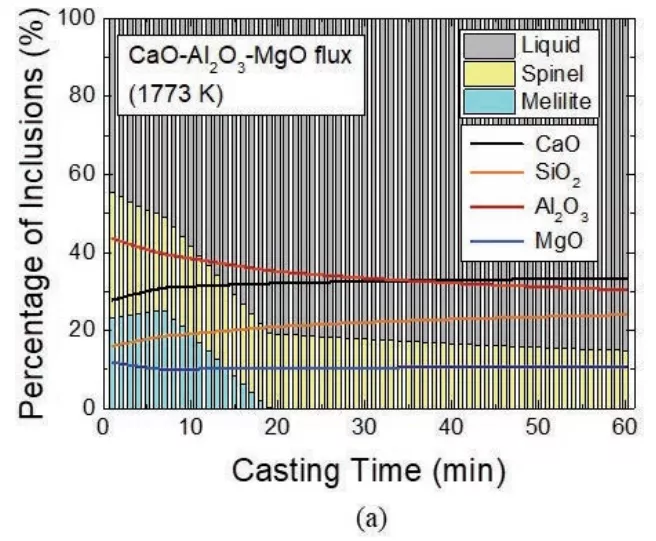
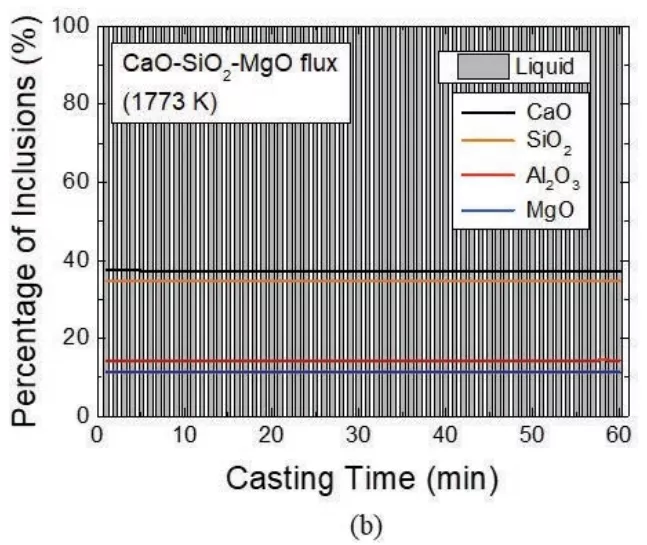
圖14 模擬鋼與中間包(a) CaO-Al2O3-MgO和(b) CaO-SiO2-MgO覆蓋劑反應過程中非金屬夾雜物隨澆注時間的變化規律
由于在實際連鑄過程中,中間包覆蓋劑是連續(或開關方式)加入到鋼水中的,模擬結果表明,CaO- Al2O3基覆蓋劑的加入,在鋼到達結晶器之前在中間包中形成氧化鋁和/或尖晶石型夾雜物。因此,在生產高潔凈度Si鎮靜不銹鋼時,建議使用CaO-SiO2基覆蓋劑來抑制中間包有害夾雜物的形成。
4. 結論
采用高溫實驗方法,研究了CaO-Al2O3-MgO和CaO-SiO2-MgO覆蓋劑對連鑄中間包中Si -鎮靜304不銹鋼鋼水中非金屬夾雜物演化機理的影響。此外,基于耐材-渣-金屬-夾雜物ReSMI多相反應模型進行了計算模擬,預測了連鑄過程中中間包中非金屬夾雜物的演化。本研究結果可歸納如下:
(1)在硅鎮靜304不銹鋼中加入CaO-Al2O3-MgO覆蓋劑后,鋼中的鋁含量隨著反應時間的延長而不斷增加,這是因為鋼中的硅還原覆蓋劑中的Al2O3,鋼與CaO-Al2O3-MgO覆蓋劑在鋼/渣界面發生化學反應,導致鋁的累積,降低了界面處的可溶性氧含量,從而使鋼中氧含量隨反應時間的延長而降低。另一方面,當CaO-SiO2-MgO熔劑加入到Si-鎮靜的304不銹鋼鋼水中時,鋼中的元素含量變化很小。
(2) 從鋼水和CaO-Al2O3-MgO覆蓋劑界面反應得到的鋁修改了前期存在的MnO-SiO2夾雜物,通過還原MnO和SiO2使其成為富鋁的夾雜物。雖然鋁含量不斷增加, 很難在鋼中沉淀析出新生粒子,由于鋼水和CaO-Al2O3-MgO覆蓋劑界面反應降低了氧含量,降低了鋼中氧化鋁的過飽和析出。尖晶石型夾雜物的多面體形態是由鋁、鎂和氧的擴散決定的,因為夾雜物的生長速度相對較慢。在CaO-SiO2-MgO覆蓋劑的作用下,Si-鎮靜的304不銹鋼中夾雜物的組成和形態變化很小。
(3)計算模擬中值得注意的是,CaO-Al2O3基覆蓋劑在連鑄過程的初始階段,將Mn硅酸鹽夾雜物顯著地改變為尖晶石型和黃長石型夾雜物。而CaO-SiO2基覆蓋劑對Si鎮靜的304不銹鋼中夾雜物的改性影響較小。